人才强校 | 我校王兴副教授在Nature子刊发表封面文章 首次报道野生蚯蚓高质量全基因组
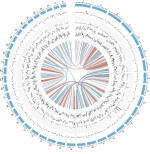
本网讯 1月29日,我校资源与环境学院王兴副教授在Nature子刊Communications Biology发表了题为“Amynthas corticis genome reveals molecular mechanisms behind global distribution”的研究论文。该研究基于长读段三代测序与Hi-C测序相结合的策略,对蚯蚓基因组进行了高质量拼装,形成了一个长达1.2 Gb,包含42条准染色体序列的基因组。蚯蚓基因组拼装序列的N50长度达到31 Mb,结合转录组测序数据共预测出29,256个蛋白质编码基因,且91.2%的后生动物单拷贝直系同源基因都在该基因组中存在完整匹配,证明该基因组具有较高的完整性。完整的基因组,为深入探究隐藏在蚯蚓物种独特性背后的分子机制提供了先决条件。
达尔文在晚年的时候,开启了一段看似平淡却又独特的研究,研究的对象就是隐伏于地下的蚯蚓,并在1881年出版的《腐殖土的形成与蚯蚓的作用》中说:“我们很难找到其它的生灵像它们一样,虽看似卑微,却在世界历史的进程中起到了如此重要的作用”。在这以后,越来越多的科学家发现蚯蚓的存在可以显著提升土壤的肥力,降低土壤有毒物质,增加土壤微生物群落的多样性,是土壤污染状况的指示生物。这个被达尔文视为卑微却又伟大的“生态系统工程师”和人类协作了几千年,帮助人类高质量和高效地从土地获取食物。
皮质远盲蚓(Amynthas corticis)是一种东亚起源并通过物理传播入侵到世界各地的广布种蚯蚓,有研究认为该种蚯蚓的入侵性是与其独特的基因组特征(多倍体)和生殖方式(孤雌生殖)相关的。多倍体可以为蚯蚓提供更多用于演化或表达优势性状的基因组材料,而孤雌生殖则可以帮助蚯蚓更稳定地保留优良性状。另一方面,蚯蚓与土壤及其肠道微生物存在非常紧密的互作关系,基于这种互作关系,蚯蚓可以改变土壤中各组分比例(提高土壤肥力、降低土壤土壤中的污染物),并优化土壤微生物群落结构(提高有益菌比例、降低有毒微生物比例),也可以使自身在土壤复杂的环境中成功的生存下来。这些独特现象的分子机制都被编码在蚯蚓的基因组中,对其基因组的深度解析将会撩开这片神秘的面纱。
图1 蚯蚓基因组概览
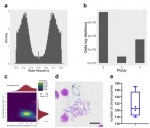
首先需要回答的,是蚯蚓基因组的倍性问题。在本研究中,对若干蚯蚓个体的高深度重测序数据显示,蚯蚓基因组中的单核苷酸多态性存在两个频率峰值,分别是1/3和2/3,说明蚯蚓的双等位基因在基因组中具有三个拷贝。另外,从重测序读段中提出的杂合k-mer序列的基因组覆盖分布上来看,高达88%的数据支持杂合k-mer序列的总体覆盖度是3n,而包含单核苷酸多态性k-mer序列的标准化覆盖度是1/3,从另一个角度证明了蚯蚓的三倍体特征。为了直接观察到蚯蚓基因组的染色体数目,本研究进行了核型分析,发现蚯蚓具有多于120条的染色体,如此巨大的染色体数目更直观地显示出蚯蚓的三倍体特征。三倍体生物在减数分裂过程中,其染色体是无法进行正常联会的,因此该倍性特征也支持蚯蚓的孤雌生殖方式。有意思的是,与Amynthas corticis世界广布种不同,一些区域性分布的蚯蚓,如Eisenia fetida和Eisenia andrei,它们都是二倍体生物。这种蚯蚓基因组倍性的多样性是否与其自然分布特征存在一定的关联性,还有待进一步的研究。
图2 蚯蚓基因组三倍体特性分析。a, 蚯蚓基因组单核苷酸多态性位点频率分布。b, 蚯蚓基因组倍性最大似然法统计检验。c, 蚯蚓基因组杂合k-mer序列基因组覆盖分布。d, 蚯蚓染色体核型分析。e,蚯蚓染色体数目统计。
蚯蚓在具有充足基因组材料的基础上,沿着怎样的演化路径加强了它应对外界环境的适应能力呢?本研究基于对物种谱系的基因家族演化分析发现,该蚯蚓为了更好的环境适应能力,走了一段与其他环节动物相比不同寻常的演化之路。首先,蚯蚓基因组的大小分别是其他环节动物海蠕虫(Capitella teleta)的3.87倍和水蛭(Helobdella robusta)的5.49倍,说明蚯蚓的整体演化策略是基因组扩张。更奇特的是,对物种谱系中加速演化的基因家族进行相关性以及PCA分析后发现,蚯蚓与海蠕虫以及水蛭具有很大差异,这种差异使得蚯蚓已经离开了环节动物的范畴。更细致的分析发现,造成蚯蚓和其他环节动物巨大差异的主要驱动力是与环境适应相关基因家族的加速演化,这些基因家族的功能涉及免疫系统过程(immune system process),胁迫应激(response to stress)和稳态过程(homeostatic process)。而且,基因家族的演化在蚯蚓内部产生了分歧,与Eisenia fetida和Eisenia andrei相比,Amynthas corticis中与环境适应相关基因家族的演化更加剧烈。这种剧烈的演化是不是也给蚯蚓的全球分布提供了必要的遗传基础?
图3 蚯蚓非比寻常的演化之路。a, 加速演化基因家族物种谱系间相关性分析。b, 加速演化基因组家族物种谱系PCA分析。c, 加速演化基因家族功能富集分析。
科学家在探索蚯蚓环境适应能力背后分子机制的道路上从未停留,克隆并深入研究了很多功能性基因。蚯蚓基因组的完整拼装,为在基因组框架下系统性地研究这些基因的分布、物种多样性以及功能相关性提供了前提条件。本研究对蚯蚓的细胞溶解酶(包括fetidin、lysenin和coelomic cytolytic factor),抗菌蛋白(包括lumbricin I、LBP/BPI和lysozyme),具有先天免疫功能的toll-like受体(包括mccTLR和sccTLR),氧胁迫应激蛋白(包括SOD,CAT和CRT),金属胁迫应激蛋白(PCS),异生物质解毒蛋白(包括GST和CYP450)以及热应激蛋白(HSP70)在基因组中进行了系统的鉴定,发现它们倾向出现在基因组倍增区域,并具有更高的基因家族扩张趋势,这为蚯蚓适应环境提供了较为充足的分子基础。另一方面,包含这些基因的基因组区域具有更富集的单核苷酸多态性位点,预示着这些基因具有更高的种内多样性,使其在不同细分生境中更灵活地发挥功能,也为这些基因的持续演化提供了丰富的突变原材料。
图4 蚯蚓在逆境中对基因组进行精准的时序调控。a, 不同时间点蚯蚓基因组高表达基因分布。b, 不同时间点蚯蚓肠道高丰度微生物分布。c, 不同时间点蚯蚓基因组高表达基因功能分布。d, 不同时间点蚯蚓肠道高丰度微生物功能分布。
本研究试图解析蚯蚓与土壤及其肠道微生物紧密互作的分子机制。为了清晰展现互作的过程,将蚯蚓培养在致病性大肠杆菌(Escherichia coli O157:H7)污染的土壤中,然后分别在置入前和置入后3天、7天以及28天等四个时间点获取蚯蚓的体壁及肠道微生物样本,进行iTRAQ差异蛋白质组学鉴定以及16S rDNA测序,揭示蚯蚓如何调动自身基因组及其肠道微生物应对土壤环境的胁迫。
差异表达蛋白分析结果显示,蚯蚓在四个时间点中都高表达了具有不同功能特征的基因,而这些基因的功能又彼此联系,展现出精准的时序调控关系:在土壤污染前,蚯蚓中高表达基因与基础细胞功能相关,包括细胞骨架组织(cytoskeleton organization)、蛋白质运输(protein transport)、跨膜运输(transmembrane transport)和信号转导(signal transduction),说明此时蚯蚓处于正常的生理状态;致病性大肠杆菌(Escherichia coli O157:H7)污染3天后,蚯蚓体高表达基因与防御功能以及细胞群体行为相关,包括胁迫应激(response to stress)、免疫系统过程(immune system process)、细胞群体增殖(cell population proliferation)和细胞粘连(cell adhesion),说明此时蚯蚓已经开始动员基因组中的相关组分应对环境的胁迫,尤其是基于细胞功能的防御机制;在置入到污染土壤7天后,蚯蚓中高表达基因与代谢分解过程和共生过程相关,包括糖类代谢过程(carbohydrate metabolic process)、小分子代谢过程(small molecule metabolic process)、辅酶代谢过程(cofactor metabolic process)、胞源氮化合物代谢过程(cellular nitrogen compound metabolic process)、分解过程(catabolic process)和共生过程(symbiotic process),说明此时蚯蚓已经开始采用基于体液功能的防御机制应对环境胁迫,也表明此时蚯蚓肠道微生物与蚯蚓的互作发生了增强。在置入到污染土壤28天后,蚯蚓中高表达基因与稳态过程(homeostatic process)相关,表明在经历了一系列应激反应后,蚯蚓已经适应了污染土壤,并开始重新构建生物体内的稳定状态。
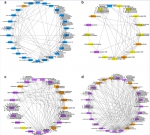
图5 蚯蚓基因组与肠道微生物互作网络。a, 蚯蚓被置入污染土壤前特征性互作网络。b, 蚯蚓被置入污染土壤3天后特征性互作网络。c, 蚯蚓被置入污染土壤7天与28天后特征性互作网络。d, 蚯蚓被置入污染土壤28天后特征性互作网络。
当基于蛋白的表达强度以及肠道微生物16S rDNA丰度构建互作网络的时候,发现4个互作网络均反映出在蚯蚓和蚯蚓肠道微生物之间存在较强的协同效应,共同维持着蚯蚓在不同时间点的生理需求。第一个互作网络中,有96%的网络组分(包括蚯蚓蛋白以及蚯蚓肠道微生物)在蚯蚓被置入污染土壤之前具有最高的表达或丰度,功能与代谢和应激相关,显示出蚯蚓在正常环境下的生理状态。第二个互作网络中,有65%的网络组分在蚯蚓被置入污染土壤3天后具有最高的表达或丰度,功能与免疫系统过程以及抗病性激活相关,说明这个互作网络是蚯蚓受到致病性大肠杆菌胁迫后形成并在应对胁迫的起始过程中发挥作用。第三个互作网络中,有95%的网络组分在蚯蚓被置入污染土壤7天或28天后具有最高的表达或丰度,功能与各类防御过程、细菌素合成以及免疫功能调节相关,说明这个互作网络在蚯蚓应对胁迫过程中发挥核心功能。第四个互作网络中,有72%的网络组分在蚯蚓被置入污染土壤28天后具有最高的表达或丰度,功能与稳态过程以及生物体修复相关,表明这个互作网络在蚯蚓应对胁迫后恢复生理机能的过程中发挥重要作用。
本研究通过对蚯蚓基因组的完整拼装与多组学分析,揭示了世界广布种蚯蚓Amynthas corticis的三倍体特征及其与土壤和肠道微生物紧密互作的分子机制,并为相关研究提供了丰富且多元的数据资源。基因组的解析,仅仅是撩开了这个卑微却又伟大的“生态系统工程师”神秘面纱的一个边角,更多的奥秘还有待深入且细致的研究来揭示。
中国农业大学资环学院副教授王兴为文章第一作者,中国农业大学孙振钧教授为文章通讯作者。共同第一作者是中国农业大学博士毕业生张一、张玉峰和康明明。共同通讯作者是中国农业大学副教授王兴和北京大学博士赵义。其他作者包括中国农业大学毕业生李元博、姜昊、毕艳孟博士、北京晶科瑞医学检验实验室有限公司杨扬以及美国玛赫西管理大学的Samuel W. James教授。本研究得到国家自然科学基金项目和中国农业大学人才培育发展支持计划等基金的支持。
文章链接: https://www.nature.com/articles/s42003-021-01659-4