人才强校 | 沈建忠院士团队在植物天然产物抗菌研究上取得重要进展
本网讯 5月27日,动物医学院沈建忠院士团队在Advanced Science发表题为“Plant natural flavonoids against multidrug resistant pathogens”的研究论文。该研究发现天然药用植物是新型化合物的重要来源,揭示85种黄酮类化合物的异戊烯基修饰可提高与细菌内膜磷脂酰甘油(PG)的亲和力,进一步丰富了PG配体的分子骨架结构,拓展了新型抗菌药物研发方向,为治疗多重耐药菌感染提供了新策略。( http://doi.org/10.1002/advs.202100749 )
天下苦耐药久矣!我国是细菌耐药性最严重的国家之一,采取措施积极防控是国家的重大战略需求。开发新型抗菌药物仍是治疗耐药性病原菌感染的最有效途径,但是新型抗菌药物研发的核心产品和技术被牢牢掌握在欧美的少数国家。发现原创性抗菌靶标及配体,开展基于靶标的分子合理设计,是破解动物专用抗菌药物创制“卡脖子”难题的关键。围绕抗菌新靶点的发现这一当前全球的研究热点与难点,沈院士团队前期研究发现细菌内膜固有的PG是理想的抗菌新靶点,设计并合成了靶向PG的亲水型先导化合物SLAP-S25(Nature Microbiology,2020)及疏水型聚集诱导发光分子TPBs(Advanced Science,2021),为抗菌活性分子筛选和新型抗菌药物开发提供了新思路。
传统的天然药用植物研究过程中存在化合物成分不清、作用机制不明等关键科学问题,如何实现从“妙手偶得”到现代药物研发“合理设计”的巨大转变,加速新型抗菌药物研发迫在眉睫。团队采用化学生态学原理结合中医经典理论对抗感染性疾病的长期实践总结,从传统中草药里挖掘天然生物防御分子,筛选中药资源宝库中新型抗耐药菌感染的天然药用分子,为中草药作为保障减抗替抗政策顺利实施提供科学依据和化合物基础。基于前期研究发现并确证的抗菌新靶点PG,建立了热动力学模型辅助的药物分子设计方法,以植物中富含的黄酮类化合物为母核结构(骨架为C6-C3-C6),通过构效关系分析深入研究具有膜靶向作用的异戊烯基修饰对抗菌活性的影响,获得多种黄酮类抗菌先导化合物。
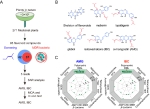
图1. AMG及IBC对革兰阳性菌的抗菌活性及恢复革兰阴性菌对多黏菌素的敏感性
在本研究中,团队筛选出具有良好抗菌效果的异戊烯基化黄酮化合物,如α-倒捻子素(AMG)和异补骨脂查尔酮(IBC)。AMG及IBC不仅对甲氧西林耐药金黄色葡萄球菌(MRSA)和万古霉素耐药肠球菌(VRE)具有优异的抗菌效果,而且可恢复多重耐药革兰阴性菌对多黏菌素的敏感性。通过构效关系分析揭示,往往具有两个异戊烯基,特别是C8、C6、C3和C3’位异戊烯基对黄酮化合物发挥抗菌活性至关重要。
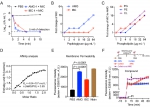
图2. AMG及IBC通过干扰细菌膜发挥抗菌活性
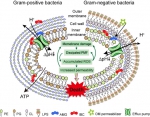
机制研究表明,AMG及IBC呈现快速的杀菌效果且不易产生耐药性,能在10分钟内杀灭细菌。AMG及IBC作用后,细菌细胞膜的通透性明显增加。对细菌细胞壁和细胞膜成分进行靶点筛选,发现AMG及IBC均可与PG高度亲和。值得注意的是,当革兰阴性菌外膜的LPS发生缺陷时,均可被AMG或IBC灭活,印证了带有异戊烯基的黄酮化合物靶向细菌内膜的假设。为了进一步解析AMG及IBC的潜在抗菌机制,团队重点探讨了其对细菌膜功能的影响。AMG及IBC处理后,细菌内膜流动性显著下降,细菌质子动力势(PMF)耗散,胞内ATP水平也发生相应变化。此外,IBC的活性依赖于细胞内ROS的积累进而加重膜损伤,但AMG呈现非ROS依赖的抗菌活性。
AMG及IBC在体内外多种感染模型中,包括伤口感染模型、VRE肠道定殖模型、肉腐败模型及消毒模型均表现优异的抗菌效果。研究结果揭示了黄酮类化合物具有多靶点特性,可以通过不同的杀菌机制靶向细菌质膜对抗耐药病原菌。因此,天然植物可以作为挖掘新型抗菌分子的资源宝库,拓展了新型抗菌药物筛选的来源,为治疗多重耐药菌感染提供了新策略。
图3. AMG/IBC抗菌机制示意图
该结果与团队前期研究共同表明细菌内膜固有的磷脂酰甘油可作为抗菌新靶点,并基于热动力学模型辅助的药物分子设计方法获得了3类骨架结构不同的抗菌先导化合物,丰富了抗菌药源分子库,为新药创制奠定化合物基础,为从抗菌新靶点和药源分子发现的源头提升药物创制水平提供理论基础和技术支持。
我校动物医学院博士后宋玫蓉、李婷婷和博士生刘颖为共同第一作者,沈建忠院士和朱奎教授为共同通讯作者。本研究获得了国家重点研发计划、国家自然科学基金和博士后创新人才支持计划等项目资助。