人才强校 | 董娜研究组揭示全新的天然免疫通路激活模式
本网讯 4月29日,我校动物科技学院董娜教授研究组和北京生命科学研究所邵峰院士研究组在致病菌感染与天然免疫研究中取得新进展,在《The EMBO Journal》杂志上(IF: 10.577) 在线发表题为“The N-end rule ubiquitin ligase UBR2 mediates NLRP1B inflammasome activation by anthrax lethal toxin”的研究论文。该文章阐明了一种机体拮抗病原菌感染的、独特的天然免疫受体激活模式。
脊椎动物已经进化出先天免疫系统和适应性免疫系统来对抗感染、疾病和其他不必要的生物入侵。先天免疫系统是机体应对这些挑战的第一道防线,利用各种类型的模式识别受体(PRRs),感知病原体相关分子模式 (PAMPs) 或损伤相关分子模式 (DAMPs),从而协调机体作出快速和多方面的反应。PRRs包括toll样受体 (TLRs)、核苷酸结合寡聚域样受体 (NLRs)、RIG-I样受体 (RLRs) 等。胞质内的某些PRRs识别特定的刺激,形成一个大的蛋白复合物结构,称为炎症小体。经典炎症小体如NLRP1、NLRP3、NAIP-NLRC4、AIM2和Pyrin炎症小体的组装激活炎性caspase-1,导致“警报”细胞因子pro-IL-1β和pro-IL-18的水解和释放,刺激免疫反应来消除潜在的威胁,作为非经典炎症小体受体,caspase-4/5/11 直接被内毒素的主要成分LPS激活并组装炎症小体。这些炎性caspase激活成孔蛋白gasdermin D (GSDMD),导致裂解性细胞焦亡。
作为第一个被报道能形成炎症小体复合物的NLR家族蛋白,NLRP1炎症小体的激活机制备受关注。以前的研究报道,炭疽致死毒素 (Anthrax lethal toxin,LT) 利用其金属蛋白酶活性特异性地诱导鼠巨噬细胞NLRP1B炎症小体的活化和细胞焦亡 ,但其潜在机制尚不清楚。在这一研究中,研究人员建立了一个简单而强大的双荧光细胞报告系统检测LT诱导的NLRP1B炎症小体通路ASC蛋白的聚集成点和裂解性细胞焦亡。利用该系统,他们进一步采用全基因组siRNA筛选和CRISPR-Cas9敲除筛选,寻找参与LT诱导炎症小体活化的基因。两个筛选结果表明UBR2,一种N端规则降解途径的E3泛素连接酶,是LT诱导的NLRP1B炎症小体激活所必需的。
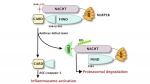
以前的研究表明,LT在NLRP1B的Lys44后酶切和NLRP1B的FIIND结构域的自水解 (F983-S984),都是NLRP1B炎症小体激活的必要前提。研究人员通过进一步研究发现UBR2通过识别NLRP1B蛋白被LT酶切后新产生的N末端Leu启动NLRP1B自身的泛素化和随后被蛋白酶体降解,从而导致C端CARD结构域的释放,激活下游capase-1 (图)。此外,E2泛素结合酶UBE2O通过与UBR2的结合也参与在这个过程中。这种蛋白降解激活模式不同于任何一种已知的NLR炎症小体,不需要保守的NBD结构域介导寡聚组装,甚至不需要完整的NLR分子,C端的CARD结构域连接一段自水解后产生的FIIND结构域片段足以启动NLR的寡聚和炎症小体的组装。这项研究成果非常确切的阐明了天然免疫防御中一种独特的炎症小体激活模式,解决了一个困扰天然免疫领域长达几十年的谜团。
图:炭疽致死毒素激活NLRP1B炎症小体的模式图。
北京生命科学研究所邵峰院士和我校动物科技学院董娜教授为本文的共同通讯作者。北京生命科学研究所徐浩博士和石建金博士为本文共同第一作者,我校动物科技学院博士研究生高航为本文第二作者,动科学院实验员刘颖为本文第三作者。本项目受科技部重点研发专项和国家自然科学基金资助。
文章链接: http://emboj.embopress.org/content/early/2019/05/06/embj.2019101996