人才强校 | 沈建忠院士团队在抗菌药物耐受性形成机制上取得重要进展
本网讯 7月28日,动物医学院沈建忠院士团队在Advanced Science(IF=15.804)发表题为“Sublethal levels of antibiotics promote bacterial persistence in epithelial cells ”的研究论文。
为应对细菌耐药性危机,沈院士团队围绕耐药病原菌控制技术开展了一系列基础和应用基础研究,首次提出广谱抗菌增效剂概念并成功合成广谱抗菌增效剂SLAP-S25,提高抗菌药物疗效(Nature Microbiology,2020);发现新型抗生素先导化合物bacaucin(杆农素)并合成系列衍生物,丰富药源分子(Angewandte Chemie,2017;Natural Product Reports,2019);提出宿主细胞介导抗菌药物耐受假说,设计“按需”给药的精准抗菌方案(Lancet Infectious Diseases,2018; Journal of Controlled Release,2020);积极开发抗菌药替代物,完善益生菌安全性评价体系,初步揭示益生分子机制(PLoS Biology,2019;Journal of Hazardous Materials,2020),为合理用药和减抗替抗提供科技支撑。
阐明细菌耐药性形成和进化机制将为合理用药和新型抗菌药物开发提供理论依据,是现在的研究热点和难点。以往研究主要集中于从细菌个体和种群水平揭示细菌耐药性形成的分子机制。近年来,发现体外低水平抗菌药物暴露会加速细菌耐受性演变,进而导致细菌耐药性形成(Science 2017)。宿主体内的细菌也会产生耐药性,如鼠伤寒沙门氏菌可自发将耐药基因传给肠道内定殖菌(Nature 2019)。但宿主细胞在细菌耐药性形成和传播中机制尚不完全清楚。相较于巨噬细胞等免疫细胞的主动内吞作用介导抗菌药物耐受性产生(Science 2018; Nature Microbiology, 2020; Cell Host Microbe, 2020),目前关于体内非免疫细胞能否及如何介导抗菌药物耐受性形成和相关机制尚不清楚。
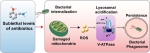
为进一步在细胞水平验证之前提出的宿主细胞介导抗菌药物耐受假说,该团队采用经典的细胞内最小杀菌浓度(intracellular MBC)方法,发现亚致死浓度抗菌药物会促进细菌入侵上皮细胞,增强抗菌药物的耐受性(抗菌药物与细菌之间“躲猫猫”);低水平抗菌药物暴露诱导宿主细胞内化的细菌在胞内存活和持留(内化的细菌与细胞形成 “特洛伊木马”)。研究结果补充了细菌在抗菌药物压力下的存活策略,完善抗菌药物耐受性产生机制,为揭示抗菌药物治疗后病原菌扩散现象的分子机制提供新思路。
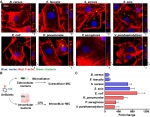
首先观察到8种常见病原菌包括4种革兰氏阳性菌和4种革兰氏阳性菌,均具有入侵宿主上皮细胞并在细胞内存活的能力。这些细胞内持留的细菌对多种抗菌药物的耐受性明显升高,甚至升高达数百倍。在小鼠肠道内低水平抗菌药物增加了包括蜡样芽孢杆菌和大肠杆菌定殖于空肠和回肠上皮细胞内的细菌载量。
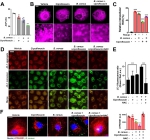
随后发现以蜡样芽孢杆菌肠毒素Nhe和金黄色葡萄球菌溶血素α-toxin为研究对象,发现低水平抗菌药物可以增强多种细菌毒力因子表达,促进细菌入侵。抑制或中和相关毒力因子有助于减少细菌入侵,这为后期筛选抗菌抑制剂提供了新的作用靶标。进一步研究发现细菌在低水平抗菌药物压力下劫持了细胞自噬应答,以使内在持留的细菌存活和生长。最后,发现低水平抗菌药物会损伤细胞线粒体,促进活性氧ROS的累积,影响溶酶体清除胞内感染菌来促进细菌存活。溶酶体膜上维持酸性环境的V-ATPase酶受抑制导致溶酶体内多种酶如ACP活性降低,最终导致细菌在细胞内持留,形成抗菌药物耐受现象。这与最近报道的V-ATPase介导病原体自噬xenophagy和细菌引发的炎性小体形成有类似机制。
在宿主体内传播抗性的细菌更容易获得耐受性表型,而耐受菌通过进化出多种策略来劫持宿主细胞以获得细胞内生存和持续感染。研究结果初步阐明体内细菌抗菌药物耐受性形成机制和抗菌药物治疗后病原菌扩散现象,为优化现有抗菌药物使用,制定耐受菌的干预策略,根除或减少持续性感染,减缓耐药性的出现提供新思路。
中国农业大学动物医学院博士生刘晓晔和刘飞为该论文的共同第一作者,我校引进的“杰出人才”朱奎教授和沈建忠院士为共同通讯作者。本研究获得了国家重点研发计划(2017YFC1600305)、中国农业大学高层次引进人才科研启动经费(2020RC002)和北京市奶牛创新团队等项目资助。